乳癌カレントトピックス
アンケート調査からみる医師主導治験の課題と展望
笠井 宏委
1
1京都大学医学部附属病院臨床研究総合センター
pp.52-54
発行日 2017年8月20日
Published Date 2017/8/20
DOI https://doi.org/10.34449/J0096.03.02_0052-0054
- 有料閲覧
- 文献概要
- 1ページ目
- 参考文献
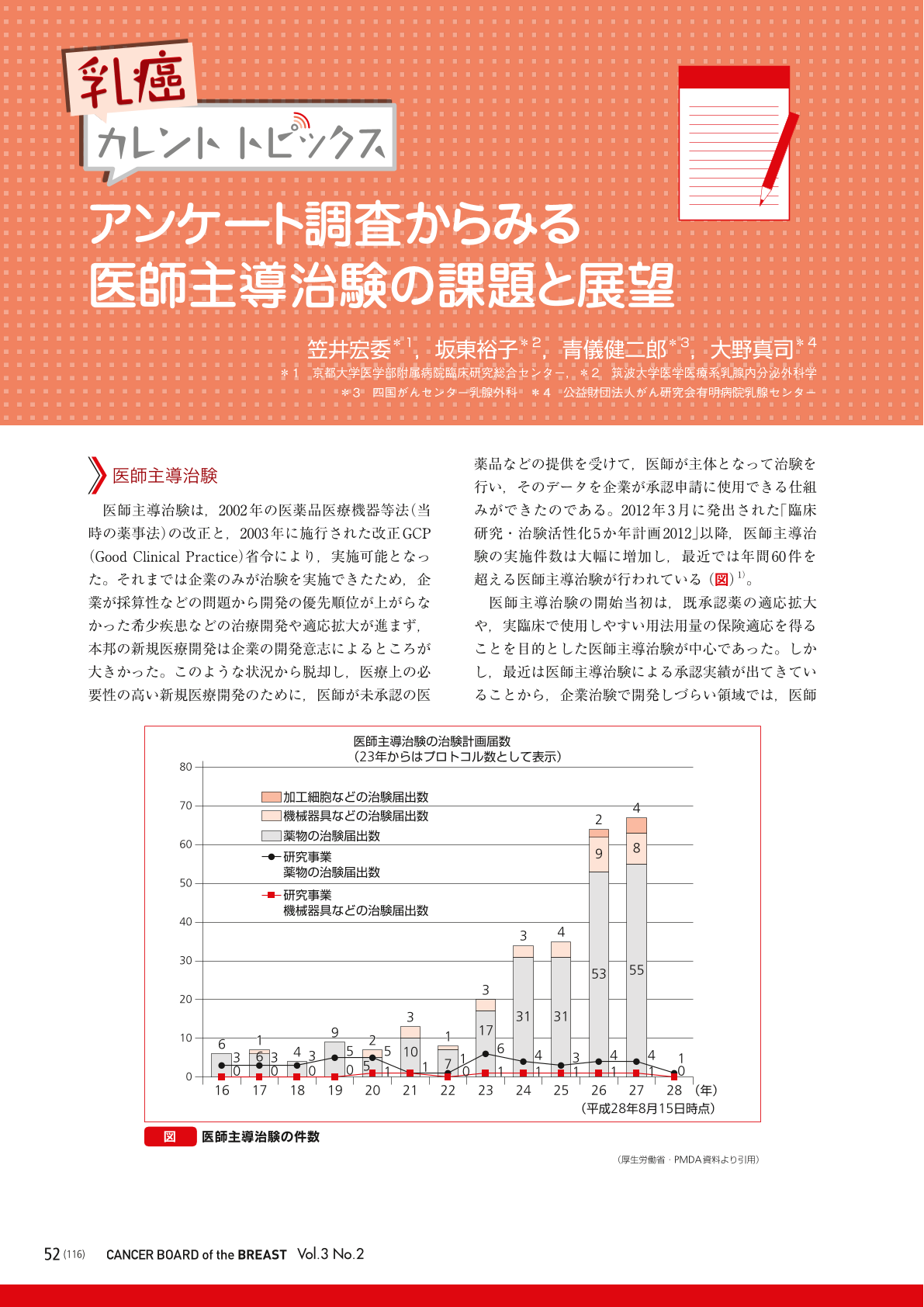
医師主導治験は,2002年の医薬品医療機器等法(当時の薬事法)の改正と,2003年に施行された改正GCP(Good Clinical Practice)省令により,実施可能となった。それまでは企業のみが治験を実施できたため,企業が採算性などの問題から開発の優先順位が上がらなかった希少疾患などの治療開発や適応拡大が進まず,本邦の新規医療開発は企業の開発意志によるところが大きかった。このような状況から脱却し,医療上の必要性の高い新規医療開発のために,医師が未承認の医薬品などの提供を受けて,医師が主体となって治験を行い,そのデータを企業が承認申請に使用できる仕組みができたのである。2012年3月に発出された「臨床研究・治験活性化5か年計画2012」以降,医師主導治験の実施件数は大幅に増加し,最近では年間60件を超える医師主導治験が行われている1)。
Medical Review Co., Ltd. All rights reserved.


