Japanese
English
- 有料閲覧
- Abstract 文献概要
- 1ページ目 Look Inside
I.はじめに
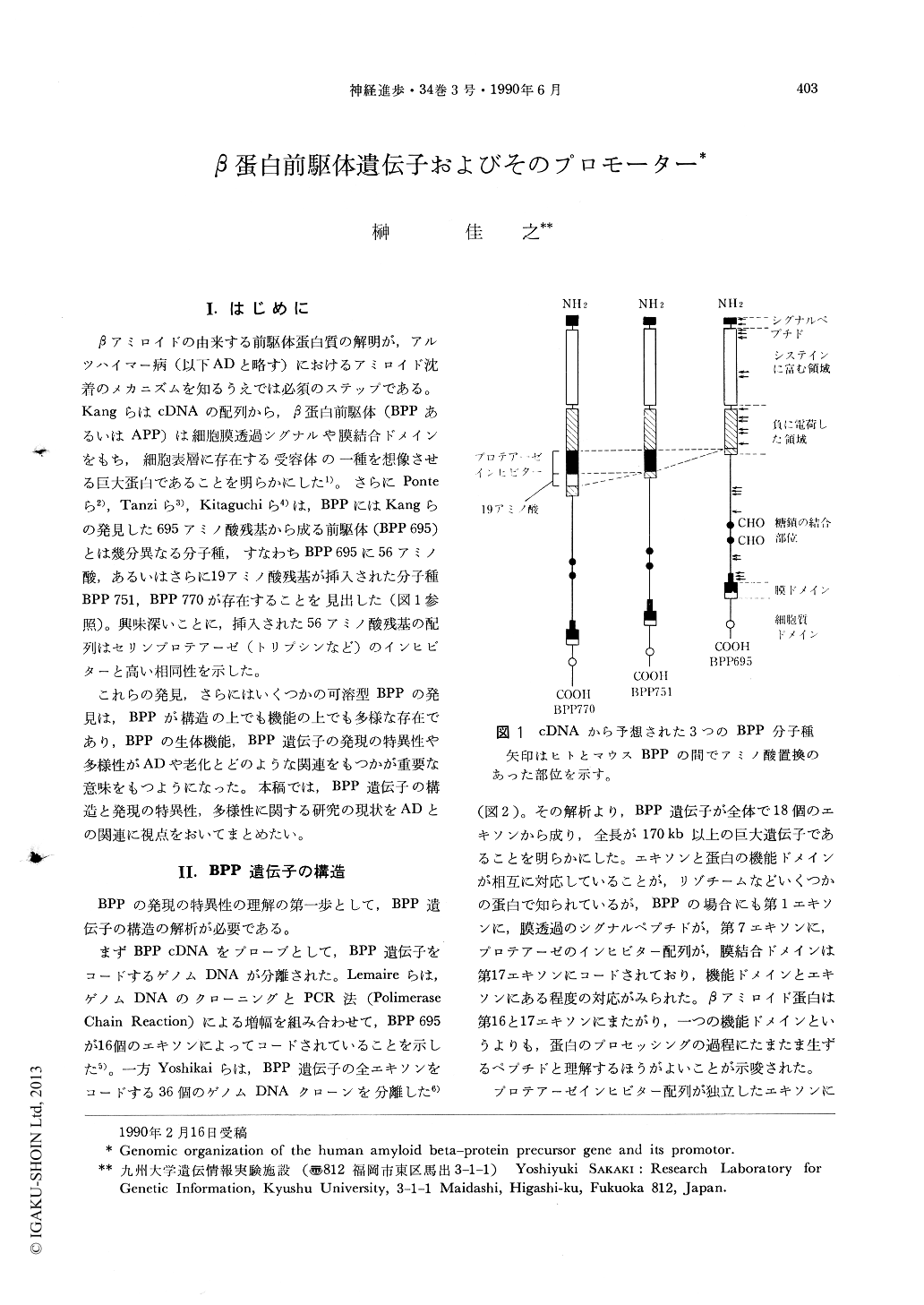
βアミロイドの由来する前駆体蛋白質の解明が,アルツハイマー病(以下ADと略す)におけるアミロイド沈着のメカニズムを知るうえでは必須のステップである。KangらはcDNAの配列から,β蛋白前駆体(BPPあるいはAPP)は細胞膜透過シグナルや膜結合ドメインをもち,細胞表層に存在する受容体の一種を想像させる巨大蛋白であることを明らかにした1)。さらにPonteら2),Tanziら3),Kitaguchiら4)は,BPPにはKangらの発見した695アミノ酸残基から成る前駆体(BPP 695)とは幾分異なる分子種,すなわちBPP 695に56アミノ酸,あるいはさらに19アミノ酸残基が挿入された分子種BPP 751,BPP 770が存在することを見出した(図1参照)。興味深いことに,挿入された56アミノ酸残基の配列はセリンプロテアーゼ(トリプシンなど)のインヒビターと高い相同性を示した。
これらの発見,さらにはいくつかの可溶型BPPの発見は,BPPが構造の上でも機能の上でも多様な存在であり,BPPの生体機能,BPP遺伝子の発現の特異性や多様性がADや老化とどのような関連をもつかが重要な意味をもつようになった。本稿では,BPP遺伝子の構造と発現の特異性,多様性に関する研究の現状をADとの関連に視点をおいてまとめたい。
Amyloid β-protein (BP) deposited in Alzheimer brains is a cleavage product of a large precursor (BPP). The BPP gene encoded three types of mRNA products generated by alternative splicing two of which direct the domain of Kunitz-type serine-protease inhibitor (serpin). The human BPP gene consists of 18 exons and spans more than 170 kb. BP is encoded by the 16th and the 17th exons and the serpin domain by the 7th exon. The 7th and 8th introns seem to lack a typical branchpoint for splicing. This might related to the alternative splicing. The promoter of the BPP gene has some characteristics of those housekeeping genes and contains a number of possible methylation sites. No alteration of methylation pattern was, however, observed among tissues and between control and Alzheimer brains. We tested the roles of two possible activator protein-1 binding sites and a possible heat-shock element found within the promoter. Northern blotting showed that the transcription of the BPP gene was appar-ently induced by 12-O-tetradecanoylphorbol-13-acetate (phorbol derivative).
Copyright © 1990, Igaku-Shoin Ltd. All rights reserved.


